安心亞任品牌大使 宣捷搶攻外泌體藍海 總座吳世揚:「我們準備好了!」
宣捷幹細胞(4724)今(21日)發表外泌體系列保養產品,並請來「全能女神」安心亞擔任品牌大使;
總經理吳世揚高呼:「外泌體絕對是眼下最紅的明星材料,順應市場趨勢,宣捷已經準備好了,因應政府法規,隨時可以開跑!」
宣捷併購竹北育禾管顧 串聯「新天龍國」婦幼產業鏈
宣捷幹細胞生技(TW-4724)今(20日)董事會通過議案,將以1千7百萬股交換育禾管理顧問股份有限公司普通股99%股權。
宣捷跨足醫美推保養品 宣昶有:外泌體為再生醫療開一扇門
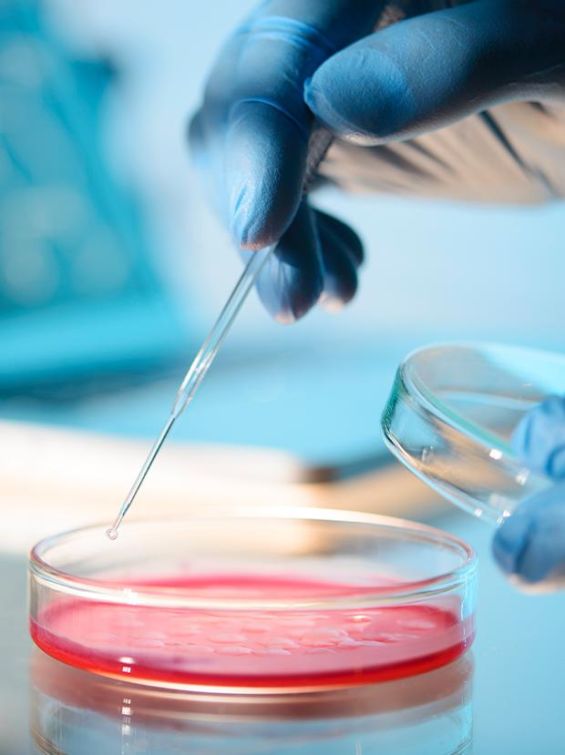
宣捷幹細胞(簡稱宣捷)跨足外泌體市場,找來影視歌三棲藝人安心亞代言,推出「EX-MU」醫美保養品。
宣捷董事長宣昶有表示,外泌體被稱為「快速幹細胞」,價位比幹細胞醫療便宜,為再生醫療打開一扇門。
真心話不冒險!宣捷爸媽感性說出對他的愛
「幫孩子儲存幹細胞,是送給他的第一個生日禮物」
Q1當初是接觸到幹細胞科技的!?〡Q2一開始對這件事有甚麼感覺?
Q3為何決定存下去?〡Q4對於經濟壓力會不會很大?
品牌合作-Lab 齒妍堂
Lab 齒妍堂創立於2012年,是百萬媽咪見證的台灣在地品牌,提供產後育兒相關產品,產品均通過專業認證,以及專業牙醫師把關,寶寶口腔清潔護理問題,都能夠在Lab齒妍堂找到合適的產品!
興櫃:搶攻外泌體藍海,宣捷幹細胞(4724)準備好了
宣捷幹細胞(4724)21日發表外泌體系列保養產品,並請來「全能女神」安心亞擔任品牌大使。
總經理吳世揚表示,外泌體絕對是眼下最紅的明星材料,順應市場趨勢,宣捷已經準備好了,因應政府法規,隨時可以開跑!
宣捷搶攻外泌體藍海 總座吳世揚:「我們準備好了!」
宣捷幹細胞(4724)昨(21)日發表外泌體系列保養產品,並請來「全能女神」安心亞擔任品牌大使;
總經理吳世揚高呼:「外泌體絕對是眼下最紅的明星材料,順應市場趨勢,宣捷已經準備好了,因應政府法規,隨時可以開跑!」
宣捷6.47億併購竹北育禾管顧 整合婦嬰服務上下游
由聯電榮譽副董事長宣明智創立的宣捷幹細胞生技今天宣布,以1700萬股交換育禾管顧普通股99%股權,併購金額約新台幣6.47億元,董事長宣昶有表示,公司將整合婦幼服務,以增加營運規模。
宣捷幹細胞換股取得育禾管顧股權 切入婦幼診所、月子中心
興櫃宣捷幹細胞生技(4724)今(20日)董事會通過議案,將以1700萬股交換育禾管理顧問公司普通股99%股權。
宣捷砸6億元併購竹北育禾管顧 取得婦幼、產護四據點
宣捷幹細胞(4724)20日宣布,董事會通過議案,將以1,700萬股交換育禾管理顧問公司普通股99%股權, 依宣捷股價換算,併購金額約6億元。
整合婦幼服務!宣捷幹細胞併購竹北育禾管顧 99% 股權
宣捷幹細胞今日召開重訊說明會,董事會通過將以 1,700 萬股交換育禾管理顧問普通股 99% 股權,
未來將透過併購策略,擴大生態鏈及策略結盟,以增加營運規模,提升核心競爭力。